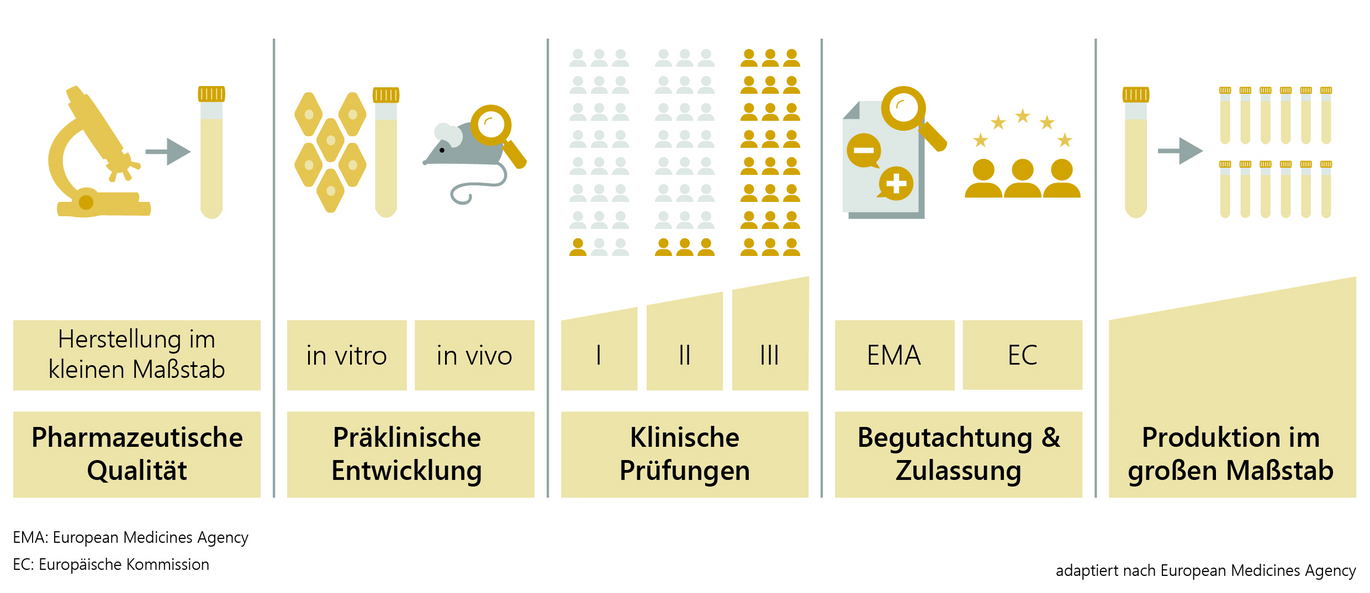
Die Pharmakonzern Moderna hat prompt reagiert, als die US-Food-and-Drug-Administration (FDA) kürzlich eine Verstärkung der klinischen Anforderungen für neue Impfstoffspezies bekannt gab. Einen Tag später zog das Unternehmen seinen Zulassungsantrag für einen Kombi-Impfstoff gegen Influenza und Covid-19 zurück. Moderas Entscheidung ist als Zeichen dafür gedeutet worden, dass Big Pharma unter der neuen FDA-Leitung von Robert F. Kennedy enger beobachtet wird.
Im Detail hat die FDA erklärt, dass künftig für die Zulassung von Impfstoffen zur Auffrischung gegen Covid-19 bei gesunden Menschen unter 65 Jahren mehr klinische Daten erforderlich seien. Moderna reagierte darauf umgehend und zog seinen Antrag auf den Kombi-Impfstoff zurück, obwohl das Unternehmen den Schritt mit der Erwartung von zusätzlichen Daten aus einer Phase-3-Studie begründete.
Kritiker sehen in Moderas Rückzug möglicherweise einen Versuch, um Kritik und Bedenken der FDA zu vermeiden. Die Aktien des Unternehmens fielen daraufhin kurzfristig um 1,4 Prozent, was unterstreicht, dass die Veränderungen im Zulassungsprozess für den Pharmasektor bedeutsame Auswirkungen haben.
Moderas Hoffnung ruht nun auf einer baldigen Zulassung seiner neuen Covid-Impfung, die ohne Influenza-Komponente entstanden ist. Die FDA soll in Kürze eine Entscheidung treffen. Letzte Woche erhielt ein neuer Novavax-Covid-Impfstoff von der Behörde bereits die Genehmigung – jedoch nur für ältere Menschen und Risikopatienten.
Die Entwicklung zeigt, dass das Impfgeschehen zunehmend differenzierter kontrolliert wird. Generalisierte Empfehlungen zur Impfung scheinen vorbei zu sein.